Ifølge en artikkel i Nettavisen fra 2. februar 2023, mener Preben Aavitsland at det sveitsiske Rent-Blod-initiativet «SafeBlood» er helt unødvendig [1]. Dette fordi han tror at koronavaksinen forsvinner raskt fra kroppen:
Innholdet i koronavaksinen gjør jobben sin raskt og forsvinner så fra kroppen. Etter syv dager kan man bli blodgiver. Da er det ikke noe av innholdet i disse vaksinene som blir med over i blodet som gis.
Aavitsland tar feil her på to områder: For det første er det flere bevis på at det fortsatt finnes «noe av innholdet i disse vaksinene» etter 7 dager i blodet til vaksinerte. For det andre er det utilstrekkelig å fokuserer kun på innholdet i «vaksinene» og ikke injeksjonsrelaterte stoffer, slik som f.eks. spike-proteinet eller metabolitter av lipidnanopartiklene.
Det finnes heller ingen dokumentasjon verken i litteraturen eller fra Pfizer og Moderna på at «vaksinen» forblir i deltoid-muskelen etter injeksjon, og at spike-proteinet dermed kun produseres lokalt.
Nedunder kommer en gjennomgang av den aktuelle faglitteraturen.
Allerede i 2012 publiserte tyske forskere en artikkel [2] med tittelen «Accumulation of nanocarriers in the ovary: A neglected toxicity risk?» [norsk: Akkumulering av nano-carriers i eggestokk: en undervurdert toksikologisk risiko?]. Fordelingen av fire forskjellige typer nanopartikler i forskjellige størrelser ble undersøkt i rotter etter intravenøs injeksjon, bl.a. lipidnanopartikler med og uten PEG (polyetylenglykol). Det viste seg at partikkelstørrelse var avgjørende for akkumuleringen, og at alle nanopartiklene mellom 45 og 350 nm akkumulerte seg i eggestokkene, uavhengig av den kjemiske sammensetningen til partiklene.
Viktige begrep når man studerer legemidlers opptak i kroppen og fordelingen mellom blod og ulike vev/organer over tid er farmakokinetikk og biodistribusjon.
Vi skal her kun fokusere på mRNA-baserte injeksjonsprodukter mot Covid-19, dvs. Pfizer/Biontech sin Corminaty (Tozinameran) BNT162b2 og Moderna sin Spikevax (Elasomeran) mRNA-1273. Begge er basert på mRNA-lipidnanopartikkel-teknologien der en nukleosid-modifisiert messenger RNA-sekvens (mRNA) som koder for spike-proteinet er pakket inn i et syntetisk lipid.
Det er viktig å understreke at et slikt produkt er ganske komplekst. Corminaty består av 280 komponenter [3]. Det skilles i fagterminologien mellom det endelige produktet («finished product»), den aktive substansen («active substance») og andre ingredienser («excipients»). Den aktive substansen er det syntetiske kjemisk modifiserte mRNAet. Farmakokinetikk undersøker hvordan både legemidlet i sin helhet og de enkle komponentene fordeler seg, brytes ned og skilles ut etter inntak. Bildet blir enda mer komplekst når det tas hensyn til at både Corminaty og Spikevax, teknisk sett, faller inn under det som kalles en «prodrug» https://sml.snl.no/prodrug, dvs. at produktet i seg selv ikke er farmakologisk aktivt, men virker ved at den omdannes kjemisk eller biokjemisk til et nytt produkt som er den aktive substansen. Selve mRNAet er ikke, eller bare i liten grad, farmakologisk aktiv, men dets transkripsjonsprodukt – spike-proteinet – er den farmakologisk aktive substansen. I slike tilfeller stilles det normalt enda høyere krav for prodrugs når det gjelder farmakokinetikk, fordi sammenhengen mellom dose og effekt er vanskelig å bestemme når den farmakologisk aktive substansen først foreligger etter kroppen har produsert den.
En fullstendig undersøkelse av farmakokinetikk består av flere trinn (Figur 1).
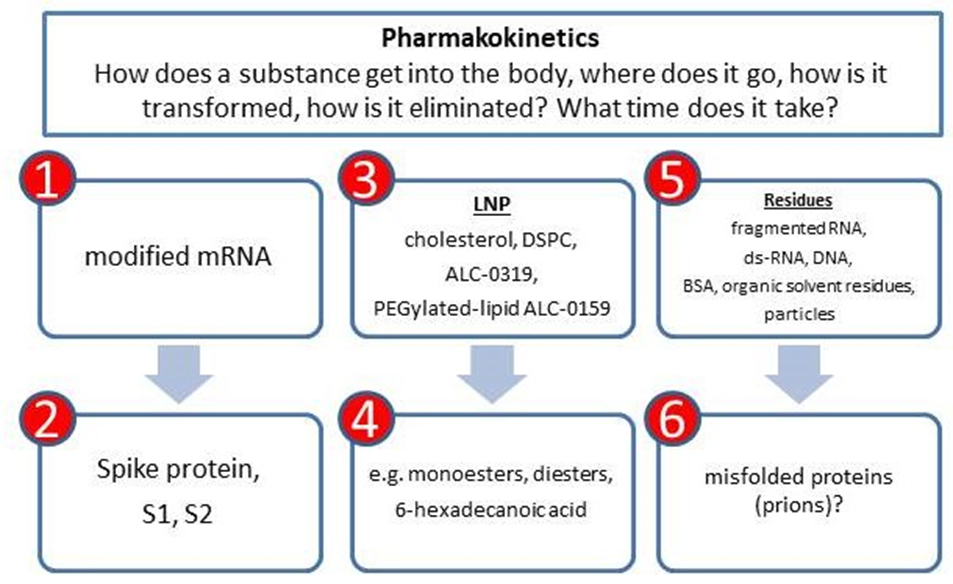
Første steg innen farmakokinetikk er å undersøke distribusjon, metabolisme og utskillelse av de primære ingrediensene:
- mRNA som koderer for spike-protein – et syntetisk, kjemisk modifisiert molekyl der uridin, en av de fire «byggesteinene»/nukleotidene i RNA, er byttet ut med N1-metyl-pseudouridin. mRNAet er også codon-optimalisert, dvs. spesifikke nukleotider ble valgt for å kode for aminosyrer. Sekvensen har et særeget design (5’ end capping og en Poly-A tail).
- lipidnanopartikler (LNPs) og dens komponenter, i Corminaty BNT162b2: kolesterol, DSPC, ALC-0315 (kationisk lipid) og PEG-lipid ALC-0159; i Spikevax mRNA-1273: SM-102 (kationisk lipid) og PEG-2000DMG i stedet for ALC-0315 og ALC-0159.
- rester fra produksjonsprosessen (dobbelstrenget-RNA, fragmentert RNA, avkuttet RNA (truncated RNA), DNA, og rester og forurensinger fra lipidsyntesen og produksjonsprosessen [4 og 5].
Andre steg er å karakterisere og undersøke distribusjon, persistens og utskillelse av de kjemisk omdannete/sekundære produktene, som er
- spike-proteinet
- metabolitter, særlig av de syntetiske lipidene ALC-0315 og ALC-0159, SM-102 og PEG-2000DMG
- andre eventuelle transkripsjonsprodukter av injisert RNA [6]
En fullstendig undersøkelse av farmakokinetikken til de nevnte mRNA produktene er svært omfattende og har fortsatt ikke blitt tilstrekkelig gjennomført av produsentene. Under nødgodkjenningsprosessen krevde regulerende myndigheter hhv. EMA og FDA, dokumentasjon på bl.a. farmakokinetikk fra pre-kliniske studier, men svært lite og utilstrekkelig informasjon er blitt levert.
En stor del av dokumentasjonen er deklarert konfidensielt materiale, likevel har f.eks. Pfizer måtte frigi en del av dokumentasjonen etter FOIA-forespørsler eller etter rettsaker. I tillegg har det blitt publisert en del vitenskapelige litteratur rundt temaet.
Produsentene selv, dvs. Moderna og Pfitzer, har ikke gjennomført humane biodistribusjonsstudier.
Begge har gjort biodistribusjonforsøk i dyr – men – for det første ikke med samme produkt som senere ble lansert på markedet og for det andre i dyreforsøk, som var av ikke-godkjent kvalitet, dvs. «non-GLP» (reglene for «good laboratory practice» var ikke oppfylt, f.eks. for få antall forsøksdyr, dårlig testprotokoll, målinger med ikke-godkjente metoder, osv.). I biodistribusjonsstudiene med forsøksdyr (mus eller rotter) brukte produsentene enten samme LNP som i det ferdige produktet i kombinasjon med en annen type mRNA (som koder for andre proteiner enn spike) eller så brukte de samme mRNA som i det ferdige produktet, men andre komposisjoner av lipidnanopartikler (LNPs). Altså ble det ikke utført farmakokinetiske undersøkelser i dyreforsøk av det ferdige produktet til verken Corminaty (Pfizer) eller Spikevax (Moderna). Dette er dokumentert i nødgodkjennings-rapporten fra EMA; for Corminaty se side 25 i EMA-rapporten) [7] og for Moderna Spikevax se side 47 i EMA-rapporten [8].
Legg merke til at Moderna testet et helt annet produkt: mRNA-1647 – som for øvrig aldri nådde markedstillatelse. Moderna forsvarte det med at det er samme LNP-formulering. Også denne studien var «non-GLP». Det er totalt uakseptabelt at produsentene ikke testet farmakokinetikken til de endelige produktene mRNA-1273 og BNT162b2, men nøyde seg med noe som «ligner».
Mangelen på human biodistibusjon har også blitt kritisert i en vitenskapelig artikkel som ble publisert i juni 2022 av Fertig et al. [10]. Forfatterne påpeker at biodistribusjonen og farmakokinetikken ikke bare direkte påvirker immunogenitet av de nye mRNA-LNP produktene, men det bestemmer også hvorvidt disse produktene potensielt kan være toksiske. Forfatterne gjør tydelig at det muligens finnes et potensiale for at produktene kan være skadelige pga. deres farmakokinetiske profil.
1. Bevis for at syntetisk mRNA sirkulerer i blod
I motsetning til DNA er RNA svært ustabilt. Det syntetiske mRNAet i Spikevax og Corminaty er modifisiert; alle uracil-nukleotidene er byttet ut med N1-metyl-pseudouridin [7 og 8]. Dette for å øke stabiliteten slik at mRNAet ikke blir brutt ned like etter produksjonen [11]. Dette gjøres også for å unngå at immunsystemet reagerer på det [12] samt for å øke effektiviteten av translasjon [13], dvs. proteinsynteseprosessen i cellene. Det var ikke mer enn antakelser av Aavitsland at mRNAet «gjør jobben sin raskt og forsvinner så fra kroppen«. Det foreligger nå fire veldig solide studier som viser at LNP-injisert mRNA sirkulerer i blodet i flere dager og opp til uker.
A) Yeo et al. (Januar 2022) – https://doi.org/10.3389/fimmu.2021.783975
35 ammende mødre uten historie av gjennomgått Covid-19 tok del i studien der de ble injisert med BNT162b2 mRNA vaksine. Både morsmelk og blodserum ble undersøkt for Sars-CoV-2 antistoff (IgG, IgA, IgM) og BNT162b2 mRNA. For å kunne detektere BNT162b2 mRNAet ble et PCR-primerpar designet som var spesifikt for BNT162b2 nukleotidsekvensen. Blodprøver ble tatt 1-3 dager etter første injeksjon og 7-10 dager etter andre injeksjon. I 15 av 21 mødre (71 %) som donerte serumprøver ble BNT162b2 mRNA funnet i serum. I 10 kvinner var mRNA påvisning positiv 7-10 dager etter andre injeksjonen. Konsentrasjonen av mRNA i serum var sammenlignbart etter første og andre injeksjon. BNT162b2 mRNA ble også påvist i morsmelk i 4 av 31 testede kvinner på dag 1 og 3 etter første injeksjon (2 tilfeller) eller etter andre injeksjon (2 tilfeller). Morsmelkanalysen hadde den ulempen at prøvene ble lagret i private hjem før analysen. Forfatterne skriver selv at dette kan ha ført til mRNA nedbrytning, og at større studier er ønskelige for å se nærmere på mRNA og antistoff i serum og morsmelk til ammende mødre etter vaksinasjon.
I midlertid har det blitt bekreftet at små mengder LNP-injisert mRNA kan bli påvist i morsmelk etter mRNA-injeksjoner med enten BNT162b2 eller mRNA-1273. I september 2022 publiserte Hanna et al. i JAMA Pediatrics en studie der mRNA ble påvist i morsmelk i 5 av 11 undersøkte kvinner [14]. Hvilke konsekvenser mRNA i morsmelk har for det ammende barnet er ikke undersøkt.
B) Fertig et al. studien (Juni 2022)
Denne studien ble publisert i Juni 2022. Det er en forskergruppen i Romania som utviklet spesifikke PCR primer-par for å påvise syntetisk RNA i blodet av vaksinerte [15]. Basert på sekvensen publisert av uavhengige forskere [16], utviklet de en RT-PCR for å spore LNP-injisert mRNA i blodet. Utfordringen besto i å sikre spesifisiteten til PCR-testen. I dette tilfellet her var det viktig å sikre at testen ikke slår ut positiv på naturlig mRNA som koder for spike-proteinet, eller annet RNA i blodet.
De brukte blod fra uvaksinerte personer som negative kontroller for å teste primere, og de brukte BNT162b2 mRNA samt en syntetisk fremstilt enkeltstrenget DNA (tilsvarende revers-transkribert LNP-mRNA) som positiv kontroll. Så kjøpte forskere to kommersielle Sars-CoV-2-S-gen positive kontrollprøver fra ThermoFisher for å teste at primere ikke slår ut positiv på Sars-CoV-2 spike-genet. Blodprøver ble tatt fra 16 individer mellom 21 og 50 år som hadde fått injeksjonen. Ingen hadde hatt Covid før. I tillegg ble blodprøver tatt fra 3 uvaksinerte individer. Blodet ble separert i plasma og den cellulære fraksjonen, og begge fraksjonene ble undersøkt vha. RT-PCR.
Resultatene i studien viste at syntetisk mRNA sirkulerer i blodet opp til to uker etter injeksjonen. mRNA ble påvist mest i blodplasma, dvs. i væskefasen, og i mindre grad inne i hvite blodceller. Forfatterne hadde bare én prøve som ble analysert 27 dager etter vaksinasjonen, og den var under deteksjonsgrensen. Prøvene ble ikke tatt kontinuerlig over tid og antall personer de tok blodet i fra var lite. Det kan derfor ikke sies i hvilken grad resultatene er representative for den generelle befolkningen; det var heller ikke formålet.
Forfatterne konkluderte med at det injiserte RNAet påvist i blod etter 15 dager har med høy sannsynlighet potensiale for å være et funksjonell templat for spike-proteinet, og man må gå ut fra at spike blir dannet også i en 2-ukers periode etter injeksjonen.
C) Castruita et al. (Janaur 2023) – https://doi.org/10.1111/apm.13294
I Januar 2023 publiserte en dansk forskergruppe en studie der blodplasma ble undersøkt for forekomst av spike-mRNA etter injeksjonene med enten BNT162b2 eller mRNA-1273 vha. hel-genomsekvensering. Her var det 108 pasienter med kronisk hepatitt-infeksjon (HCV) som rutinemessig donerte blodprøver for HCV helgenomsekvensering av RNA-sekvenser i plasma. Forskerne fant full-lengde vaksine-mRNA eller fragmenter av mRNA i en periode fra én til 28 dager etter injeksjonen med Corminaty eller Spikevax.
I studien skriver forfattere selv at dette var «overraskende» og henviser til vitenskapelig litteratur som beskriver rask nedbrytning av naken mRNA og lipide nanopartikler. Dette er i sterk kontrast til EMA sin vurdering fra November/ Desember 2020 der konklusjonen var at resultatene fra Pfitzer tydet på at ALC-0315 (en bestanddel av lipidene) ikke brytes ned veldig fort. Det er også i kontrast til en nylig publisert artikkel som foreslår bedre nedbrytbarhet av lipide nanopartikler [17]. Castruita et al. oppsummerte slik:
Current studies on half-life of mRNA vaccines could have underestimated the half-life of the LNPs, primarily using results from half-life of studies of mRNA in cytosol of human cells.
Castruita et al. skriver at de går ut fra at injisert mRNA finnes i blodet fordi den er pakket inn i LNPer der den er beskyttet fra enzymatisk nedbrytning. Videre, at det er tenkelig at LNPer siver sakte ut i blodet fra injeksjonsstedet (delta-muskelen) eller at LNPer kom inn i blodet via det lymfatiske systemet:
Videre er det beskrevet i dyreforsøksdata og litteratur som EMA fikk tilsendt av Pfitzer/BioNTech og Moderna under nødgodkjenningsprosessen 2020 at mRNA-LNPer spredte seg via blodet over hele kroppen, og at noen av lipidene ikke metabolisertes raskt. Det er faktisk ingenting overraskende her. Resultatene til Castruita et al. bekrefter det som kunne forventes basert på EMA-nødgodkjenningsrapporten. Overraskende er det kun når man ikke har lest denne litteraturen og tror at «koronavaksinen gjør jobben sin raskt og forsvinner så fra kroppen» som Aavitsland hevder.
D) Röltgen et al. (Januar 2022) https://doi.org/10.1016/j.cell.2022.01.018
I Januar 2022 ble en stor studie publiserte i Cell der forfatterne undersøkte antistoff-respons i lymfeknutene i armehulene etter Covid-infeksjon eller injeksjon med de nye «Covid-vaksinene». De fant vaksine-mRNA opp til 60 dager etter injeksjonen i lymfeknutene. Siden lymfeknutenes funksjon er å rense lymfen før lymfevæsken dreneres til blodet er det bekymringsverdig at mRNA fra de nye gen-produktene Corminaty og Spikevax ble funnet i lymfeknutene i en såpass lang periode etter injeksjonen.
2. Bevis for at spike-proteinet og deler, derav (S1) sirkulerer i blodet
A) Ogata et al. 2022 (doi:10.1093/cid/ciab465)
Ogata et al. var nok den første gruppen som publiserte allerede i Mai 2021 – bare noen måneder etter masseinjeksjoner hadde startet – en fagfellevurdert artikkel i Clinical Infectious Diseases der det ble beskrevet at S1-fragmentet av spike-proteinet kunne detekteres i blodet i 11 av 13 vaksinerte etter første dose med mRNA-1273. Konsentrasjonstoppen av S1 i plasma var nådd 5 dager etter injeksjonen, og etter 14 dager kunne S1 ikke lenger detekteres. Spike proteinet ble påvist i plasma rundt 15 dager etter første injeksjonen i 3 av 13 vaksinerte. Etter andre injeksjonen var S1 og spike maskert pga. sirkulerende antistoff, som gjorde at deteksjons-assayet til Ogata et al. var ubrukelig for å påvise proteinene. Studien hadde en del svakheter; den hadde bare 13 deltakere og metodikken de brukte for å påvise S1, spike-proteinet og N-proteinet var ikke tilstrekkelig tilpasset forsøksspørsmålet. I konklusjonen til Ogata et al. lyder det: «Våre målinger viser at S1 antigenproduksjon etter førstegangsvaksinasjon er detekterbart den første dagen og også andre steder enn injeksjonsstedet og dets nærliggende lymfeknuter.»
B) Röltgen et al. (Cell, 2022) https://doi.org/10.1016/j.cell.2022.01.018
Röltgen et al. undersøkte forekomst av spike-proteinet i sirkulasjon. Spike-proteinet kunne detekteres 60 dager etter injeksjonen i lymfeknuter i armehulene. Det ble også funnet i blodplasma tatt 1-2 dager etter første injeksjonen i 96 % av vaksinerte som hadde donert blod. Antigenkonsentrasjon var på samme nivå (pg/mL) eller på langt høyre nivå (ng/mL) sammenliknet med konsentrasjon etter en akutt koronainfeksjon. Én uke etter førstegangsinjeksjon kunne Röltgen et al. fortsatt påvise lave konsentrasjoner av spike-proteinet i plasma i 63 % av de vaksinerte.
Etter andregangs-injeksjonen viste det seg at spike-antigenet ikke lenger kunne påvises i blodplasma fordi den var bundet i et immunkompleks hvilket så, i følge forfatternes tolkning, gjorde at immunoassayet de brukte ikke lenger kunne detektere det spesifikke epitopet av antigenet. Det betyr ikke at spike-antigenet hadde forsvunnet fra plasma, men det viser at metodikken ikke kunne påvise antistoff-bundet spike-protein.
C) Bansal et al. (DOI: 10.4049/jimmunol.2100637 )
Bansal-studien er fra November 2021 og ble publisert i The Journal of Immunology. Forskerne tok blodprøver fra 8 friske personer før og etter BNT162b2-injeksjonen. De undersøkte om spike-proteinet kunne påvises i eksosomer ekstrahert fra blodplasma 7 og 14 dager etter første injeksjon, og 14 dager etter andre injeksjon, samt 4 måneder etter første injeksjon. Konsentrasjon av spikeprotein-eksosomer var høyest 14 dager etter andre injeksjonen. Disse kunne fortsatt detekteres i lavere konsentrasjon 4 måneder etter førstegangs-injeksjonen.
Bansal et al. ekstraherte også eksosomer fra humant plasma for å injisere det i mus for så å se om musene dannet antistoff og en cellulær respons etter injeksjon med humane spikeprotein-eksosomer. Konklusjonen fra denne dyreforsøksstudien var at overførte humane spikeprotein-eksosomer var antistoff-fremkallende og at de aktiverte en cellulær immunrespons.
En blodtransfusjon er ikke helt sammenliknbart med en injeksjon av extraherte eksosomer fra humant blodplasma. Likevel viser denne studien at blodet til personer som har fått en mRNA-injeksjon inneholder spikeprotein-eksosomer som har immunogene egenskaper i dyreforsøk.
D) Yonker et al. https://doi.org/10.1161/CIRCULATIONAHA.122.061025
Studien til Yonker et al. ble publisert i starten av januar 2023 og fikk mye omtale. EMA inviterte så forfatterne til å presentere resultatene sine i en nylig avholdt seminar om vaksine-indusert myokarditt [18]. Yonker et al. sammenliknet en gruppe av 16 ungdommer med vaksine-indusert myokarditt med 45 ungdommer i en kontrollgruppe som også hadde fått injeksjonen, men var friske. Litt overraskende, så fant forskerne ingen forskjell i antistoffrespons mellom de to gruppene, og heller ikke noen forskjell i T-cell-respons. Men det viste seg at myokarditt-gruppen hadde tydelige tegn på betennelse via aktivering av det medfødte immunsystemet. For å finne ut hva som var årsaken til dette målte forskerne konsentrasjonen av spike-proteinet og dens S1-fragment i blodet, både i bunnet og i fri form. S1-fragmentet av spikeproteinet ble funnet i antistoff-bundet form i omtrent en tredjedel i begge de undersøkte gruppene opp til 3 uker etter injeksjonen. I en tredje gruppe voksne deltakere kunne forskere ikke påvise S1-fragmentet av spikeproteinet etter andregangs-vaksinasjon.
Full-lengde spikeproteinet ble funnet både i fri og i bundet form inntil 3 uker etter injeksjonen i den gruppen som hadde myokarditt. I kontrollgruppen av friske ungdommer ble full-lengde spikeprotein påvist i antistoff-bundet form i 3 av 45 individer inntil 18 dager etter injeksjonen.
3. LNPer og dens metabolitter sirkulerer i blodet
Det finnes per i dag ingen humane farmakokinetiske studier med LNPer (lipide nanopartikler) brukt i Corminaty og i Spikevax. Farmakokinetikken til de nye syntetiske lipidnanopartiklene ble undersøkt i dyreforsøk av Pfizer og Moderna. Men kun lite og til dels utilstrekkelig informasjon er tilgjengelig.
Biodistribusjon av Pfitzer-BioNTech LNPer:
Pfitzer sine farmakokinetiske studier med de to nye syntetiske lipidene ALC-0315 og ALC-0159 ble utført i mus og rotter. Dokumentene ble etterhvert tilgjengelige etter FOIA-forespørsler [19]. Pfitzer brukte ikke mRNA som kodet for spike-proteinet, men brukte i stedet en nukleotidsekvens som kodet for proteinet luciferase (stoffet som gjør at ildfluen gir av seg lys). Sammensetningen av LNPer var den samme som i BNT162b2. For å spore biodistribusjonen av LNPer i mus målte Pfizer fotometrisk luciferase-aktivitetet (bioluminescens). I studien på rotter ble LNPer markert med radioaktivt 3H-kolesterol. Begge dyreforsøksstudiene viste at LNPer fordelte seg via blodet hovedsakelig inn i lever, binyrene, milt, eggestokk og testikler. I blodplasma ble den høyeste konsentrasjon målt 2 timer etter injeksjonen. Deretter falt konsentrasjonen i plasma men økte i de undersøkte organene.
Det ble også utført en farmakokinetisk studie i rotter med to av de helt nye ingrediensene som danner LNPer brukt i Corminaty. Konsentrasjonen av ALC-0315 og ALC-0159 ble målt i plasma, lever, urin og avføring over 336 timer (14 dager) [20]. I motsetning til ALC-0159, et PEG-lipid, viste ALC-0315 en lang halveringstid i leveren. [21]. Halveringstid er tiden til konsentrasjonen av et stoff faller til 50 % av konsentrasjonen ved start. Fra EMA-rapporten om Corminaty [21] vet vi følgende:
Rotter ble injisert intravenøst med LNPer, ikke intramuskulært som i mennesker. Det er estimert at det vil ta 30-40 dager inntil ALC-0315 elimineres nesten fullstendig fra leveren i rotter etter LNPer har blitt direkte injisert i det venøse blodet. EMA antar en lignende halveringstid og en lignende 95-% elimineringstid i mennesker. Dette fordi organene som er involvert i opptak av LNPer er de samme i mennesker som i rotter og fordi omfordelingsprosessene fra organer der ALC-0315 sammler seg i til andre organer vil være sammenlignbart. Når man ekstrapolerer fra rotter til mennesker må det tas hensyn til kroppsvekt – det heter «allometrisk skalering». Med dette som utgangspunkt estimerte EMA en halveringstid for ALC-0315 i mennesker på 20-30 dager og en 95-% elimineringstid på 4-5 måneder.
ALC-0315 kunne ikke påvises i urin i den nevnte rottestudien, og bare 1% ble målt i avføring. Pfizer og EMA skrev derfor at metabolisme trolig spiller en større rolle i elimineringen av ALC-0315. Et viktig ord som ikke ble nevnt her er akkumulering. Basert på de foreliggende resultatene tyder mye på at ALC-0315 akkumulerer seg i fettvev. Akkumulering er spesielt bekymringsverdig med hensyn til at flere injeksjoner har blitt gitt og med tanke på at det har blitt vist at disse nye lipidene ga betydelige skadevirkninger i forsøksdyr [22].
Biodistribusjon av Moderna’s SM-102 LNPer:
Det er veldig begrenset informasjon tilgjengelig om farmakokinetikken til LNPer som ble brukt i Spikevax. Moderna leverte resultater fra en studie gjennomført i 2017 for mRNA-1647 [23] – et produkt som brukte samme LNPer (basert på kolesterol, DSPC, PEG2000-DMG og SM-102) som i Spikevax, men ikke samme mRNA som i Spikevax. Produktet mRNA-1647 kom aldri på markedet. Biodistribusjonen av LNPer ble ikke sporet direkte. Studien fra 2017 undersøkte i hvorvidt mRNA som var pakket inn i LNPer ble oversatt til proteiner i rottedyr etter intramuskulær injeksjon. Resultatene viste at mRNA fra LNPer fordelte seg inn i alle organene (inkludert, bl.a., hjerne, hjerte, øyene, milt, testikler, lever), unntatt binyrene. EMA vurderte studien slik at det er mest sannsynligvis LNPen som bestemmer biodistribusjonen og kun i mindre grad mRNAet i en slik LNP [8].
Moderna undersøkte ikke den kjemiske nedbrytningsprofilen til LNPer som ble brukt, verken i 2017 for mRNA-1647 eller mRNA-1273. Farmakokinetikken til bare enkeltingrediensene – de nye lipidene SM-102 og PEG2000-DMG – ble heller ikke undersøkt. Hvor lenge disse nye lipidene forblir i kroppen, hvordan de vil bli metabolisert og eliminert fra kroppen er totalt ukjent. Dette fordi det er nye substanser som aldri før har blitt brukt i et legemiddel.
4. Rester fra produksjonsprosessen
EMA har gjort en omfattende vurdering av Corminaty BNT162b og Spikevax mRNA-1273 i sammenheng med nødgodkjenningsprosessen. Ut fra dokumentasjon produsentene sendte inn ble det dokumentert at både BNT162b2 og mRNA-1273 viste prosess-relaterte forurensinger i form av både partikler, uorganisk materiale og organisk materiale.
Tilsynelatende er produksjonsprosessen ikke godt kvalitetssikret, ellers ville ikke en hel batch blitt tilbaketrukket av japanske myndigheter etter man oppdaget partikulære forurensinger, som senere viste seg å være stainless-steel partikler [24,25]. Det er stor usikkerhet i hvorvidt enkle doser er kontaminert, og det er uklart i hvorvidt slike forurensinger fordeler seg i vev, lymfe og evt. via blodet i kroppen etter injeksjonen.
Sammendrag
3 fagfellevurderte studier viser til at injisert mRNA sirkulerer i blodet: 7-10 dager (Yeo et al. 2023), 15 dager (Fertig et al. 2022), eller opp til 28 dager etter injeksjonen (Castruita et al. 2023). Studien til Röltgen et al. 2022 viste til både forekomst av mRNA og spike-proteinet i lymfeknutene opp til 60 dager etter injeksjonen. Det er bevis for at spike-proteinet eller dens underenhet, S1, sirkulerer i blodet etter vaksinasjon opptil 15 dager (Ogata et al. 2021), 3 uker etter injeksjon både fritt og i antistoff-bundet from, og opp til 4 måneder etter første dose (Bansal et al. 2021) i form av eksosomer i blodet. Det er ukjent hvor lenge de syntetiske lipidnanopartiklene eller dens metabolitter forblir i kroppen siden det ikke finnes humane biodistribusjonsstudier. For det kationiske lipid ALC-0315 i Corminaty er det estimert en 95 % eliminering etter 4-5 måneder.
Referanser
[1] https://www.nettavisen.no/nyheter/vil-tilby-nordmenn-rent-blod-hores-bare-merkelig-ut/s/5-95-885467
[2] doi:10.1016/j.jconrel.2012.02.012
[3] https://globalnews.ca/news/7667036/coronavirus-vaccine-science-supply-chains/
[4] https://doi.org/10.1038/s41467-021-26926-0
[5] https://www.cnbc.com/2021/08/26/japan-pulls-1point6-million-moderna-vaccine-doses-over-contamination-concerns-.html).
[6] https://www.fortunejournals.com/articles/huaier-effects-on-functional-compensation-with-destructive-ribosomal-rna-structure-after-antisarscov2-mrna-vaccination.html
[7] https://www.ema.europa.eu/en/documents/assessment-report/comirnaty-epar-public-assessmentreport_en.pdf
[8] https://www.ema.europa.eu/en/documents/assessment-report/spikevax-previously-covid-19-vaccine-moderna-epar-public-assessment-report_en.pdf
[10] https://doi.org/10.3390/biomedicines10071538
[11] https://pubmed.ncbi.nlm.nih.gov/21813458/
[12] DOI: 10.1016/j.immuni.2005.06.008
[13] doi:10.1093/nar/gkx135
[14] doi:10.1001/jamapediatrics.2022.3581
[15] http://doi.org/10.3390/biomedicines10071538
[17] doi: 10.1021/acsnano.2c07822
[19] https://archive.org/details/pfizer-confidential-translated.
[20] https://phmpt.org/wp-content/uploads/2023/02/125742_S1_M4_4.2.2-072424.pdf
[22] https://doi.org/10.1016/j.isci.2021.103479
[23] (https://www.judicialwatch.org/wp-content/uploads/2022/08/JW-v-HHS-Biodistribution-Prod-4-02418.pdf)
[25] https://www.newsweek.com/moderna-vaccine-recall-contamination-stainless-steel-human-error-takeda-covid-1634598

Det virker som om Aavitsland er mer fokusert på at befolkningen skal akseptere «Covid vaks» enn å diskutere på en vitenskapelig og ærlig måte.